蓮見賢一郎先生の最新の
共同執筆論文をアップしました
英文タイトルをクリックすると論文(PDF)にリンクします。
Investigation of Cellular and Humoral Immune Responses to Tumor-Associated Antigens and
Survival of Patients with Advanced Cancers Treated with Combined Radiation and Immunotherapy
(腫瘍関連抗原に対する細胞性免疫反応および体液性免疫反応と、放射線療法と免疫療法を併用した治療を受けた進行がん患者の生存に関する研究)
がん治療はこの10年間で飛躍的に発展し、各ステージの5年生存率も大きく改善しています。しかし、Ⅳ期や再発がんに対する治療も延命は可能になったものの、治癒という課題に対しては、未だ解決されずに残されています。近年PD-1の発見が免疫療法に対する概念を大きく塗り替え、免疫療法に対するイメージは大きく改善されました。特に抗がん剤との併用により、多臓器転移がある状況の進行がんにおいても一部の症例で治癒が認められています。ここでは、1995年から樹状細胞の治療に関わってきた経験をもとにHITV療法についてご説明させていただきます。
標準治療として古くから抗がん剤治療が存在しますが、近年になりがんに対する新薬は分子標的薬へと移行しています。また、放射線治療においても科学技術の進歩と共に、粒子線治療、IMRT(強度変調放射線治療)やBNCT(ホウ素中性子捕捉療法)など、より精度の高い治療法が登場してきました。これらの治療法はそれなりに高い有効性を保持していますが、Ⅳ期や再発がんなどの進行がんにおいては、延命は可能ですが治癒は困難な現状です。その背景には、それぞれの治療の特徴があると言えます。
1)抗がん剤・分子標的薬
分子標的薬と抗がん剤は共に有効な治療ですが、耐性化という問題を避けては通れません。そのため微小がんが体内に残り、それが新たな再発や再燃といった問題を引き起こします。薬剤使用の優先順位はもっとも有効性の高い薬剤から使用され、耐性化すると緩和ケアへの移行を勧められるのが、進行がんを患った患者さんの治療の流れとなっています。
2)放射線治療
一般的に放射線治療はBNCTを除いて、一度照射した部位に再度の照射はできないとされています。特に進行がんは多病巣である場合が多く、多臓器にわたります。近年はそれぞれの病変に対しても照射が可能になりましたが、目に見えない体内の微小がんに対して排除はできません。また治療部位に、照射による繊維化が起こり、後に機能障害や疼痛といった慢性障害に悩む患者さんも少なくありません。
免疫療法、特に免疫細胞療法は、一見まったく頼りにならない治療に見えますが、標準治療の弱点とされる微小がんに対して、高い排除能力を有していると言えます。その働きを担っているのがCTL(キラーT細胞)と言われていますが、免疫療法を組み立てる立場から考えると、
などが必須条件としてあげられます。もし、このようなCTLが体内に誘導できれば、血中のがん細胞を浄化することが可能となります。血液中のがん細胞が浄化されれば、その後の新しい転移を抑制できることになります。
私が樹状細胞に出会ったのは1994年頃でした。当時の国立小児病院(現:国立成育センター)の研究者の紹介で、米国スタンフォード大学のイングルマン教授の元で樹状細胞研究を学んで帰国されたばかりの研究者から、その誘導法をご教示いただきました。
1996年に悪性リンパ腫が再発した女性に使用して、腫瘍の消失後18年間存命された経験を得て以来、樹状細胞の研究に興味を持ち現在に至っています。2006年には、咽頭がんの再発進行がんの女性に対して樹状細胞の腫瘍内投与を行い、放射線治療と併用することで初めて治癒を達成でき、この患者さんは今もご健在です。
続いて翌年、胃がんの術後再発で左鎖骨上リンパ節と傍大動脈リンパ節転移の男性に対して、同様に樹状細胞の腫瘍内投与と放射線治療により治癒を達成できました。この方は現在、再生医療委員会の患者代表を務めていただいています。HITVのプロトコールはAからCまで3種類(図1)あり、プロトコールAとBを用いて多発病巣を消失まで導き、その後プロトコールCで再発予防を行い、治療開始から3年後に治療を終了します。
図1 プロトコール(A/B/C)
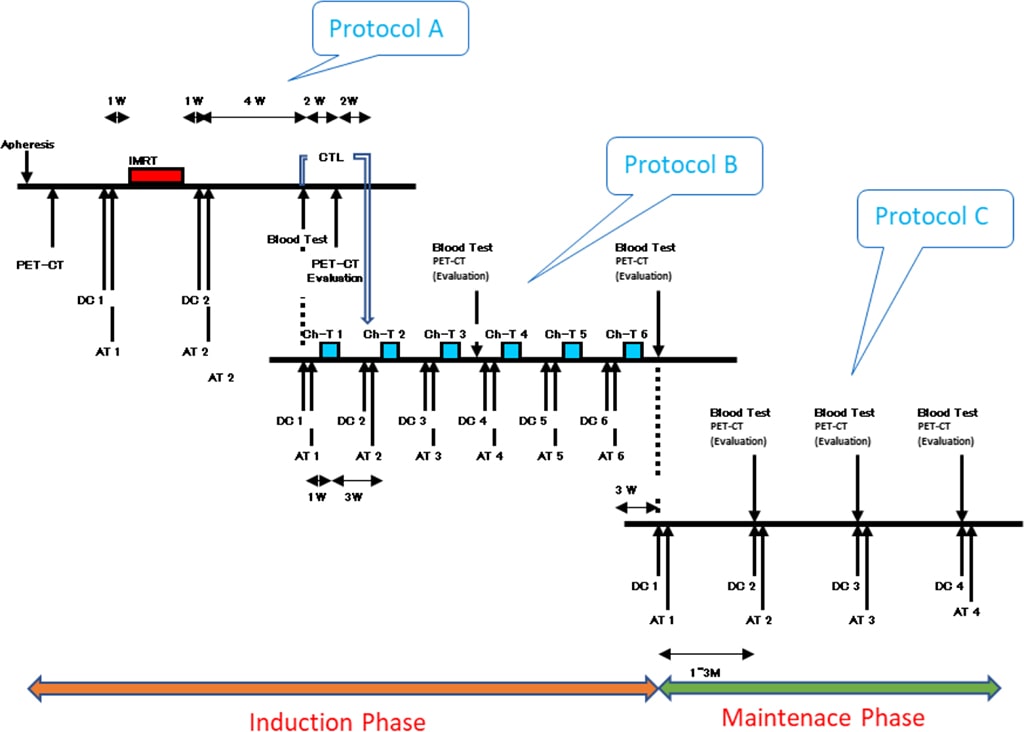
前述の最良のCTLを誘導するためには、樹状細胞の腫瘍内投与が最も良い方法であると考えます。がん組織は線維芽細胞などの支持細胞などで守られているため、動脈や静脈を通じた血管内投与では腫瘍組織内部への浸透力が弱く、結果的にCTLの誘導能も不十分な状況になると考えられます。
プロトコールAは樹状細胞の腫瘍内投与と放射線治療を併用するもので、放射線治療の前後に樹状細胞投与を行います。その結果の評価として、治療効果が不十分な病巣や新たに認められた病巣に対して、末梢血中に誘導されたCTLを分離増幅して腫瘍内投与を行うことで腫瘍消失を狙います。このプロトコールは、全体の腫瘍数が5カ所以内で最大腫瘍径3㎝以内に対して使用します。
細胞投与は、なるべく各コースの抗がん剤開始の1週間前に、動脈及び静脈を通じて投与します。その理由は、各腫瘍の炎症化の予防にあります。樹状細胞投与によって体内にメモリーが誘導され、CTLの産生が始まると同時に、抗がん剤投与後に骨髄からナイーブな血液細胞が動員されて、免疫がリセットされることが重要とされています。
プロトコールBはプロトコールAの後で行うことが多く、全体の腫瘍数が10カ所以内で最大腫瘍径5㎝以内を適応としてきました。原則としてこの両者のプロトコールが終了した段階で、すべての腫瘍の消失に至っていないといけません。
プロトコールCはプロトコールA/Bと異なり、すべての病巣のコントロールがついた後に再発予防として使用します。細胞投与は月1回を3回から開始して、徐々に投与間隔を延ばしていきます。その間に万一新病巣を認めた場合は、樹状細胞やCTLの腫瘍内投与で消失させます。
2005年に開始したプロトコールAから約16年間を経て、2021年新たにプロトコールDが加わりました。その背景には標準治療との併用ではなく、免疫療法だけによる腫瘍消失が重要だったからです。
免疫療法の最大の敵は炎症の合併にあると言えます。特に樹状細胞単独での腫瘍内投与は極めて危険で、一度腫瘍が炎症を合併すると腫瘍内にサイトカインストームを発生し、コントロールが極めて難しくなります。2021年の年末に登場したプロトコールDは樹状細胞と炎症性サイトカインの抗体薬を使用することで、標準治療との併用がなくても炎症をコントロールできることがわかってきました。2021年12月に直腸がん術後再発で腹部大動脈周囲の10カ所以上に及ぶリンパ節転移に対して、当初プロトコールA/Bの力を借りましたが、7カ月で腫瘍消失を達成することができました。この症例でも炎症性サイトカインの制御が治療経過に深く関わっていました。
現在までにプロトコールDの評価が徐々にわかってきており、
など、免疫療法のみでの力の範囲が見えてきました。
HITVは標準治療との併用において、腫瘍のワクチン化を図り、それによって誘導されたCTLで血液中の腫瘍細胞の浄化を進めることで、その後の新病巣を出さないことが最大の使命と言えます。
臨床効果は体内全体の腫瘍数、最大腫瘍径、抗がん剤と放射線治療との併用の可否、などにより結果が大きく左右されます(表)。適応範囲内での結果は良好です。3年生存率は70%前後で、3年までに再発がなければ、その後の再発を認めていません(図3)。
表 HITV の適応と非適応(腫瘍数と腫瘍径)
| 化学療法 | 放射線治療 | 適応 |
|---|---|---|
| 未治療 | 未治療 | ●腫瘍数 ≤ 10 ●腫瘍径 ≤ 5cm |
| 耐性化 | 未治療 | ●腫瘍数 ≤ 5 ●腫瘍径 ≤ 3cm |
| 未治療 | 耐性化 | ●腫瘍数 ≤ 5 ●腫瘍径 ≤ 3cm |
| 耐性化 | 耐性化 | ●適応なし |
図3 プロトコール(A/B/C)による生存率 (A/B/C)
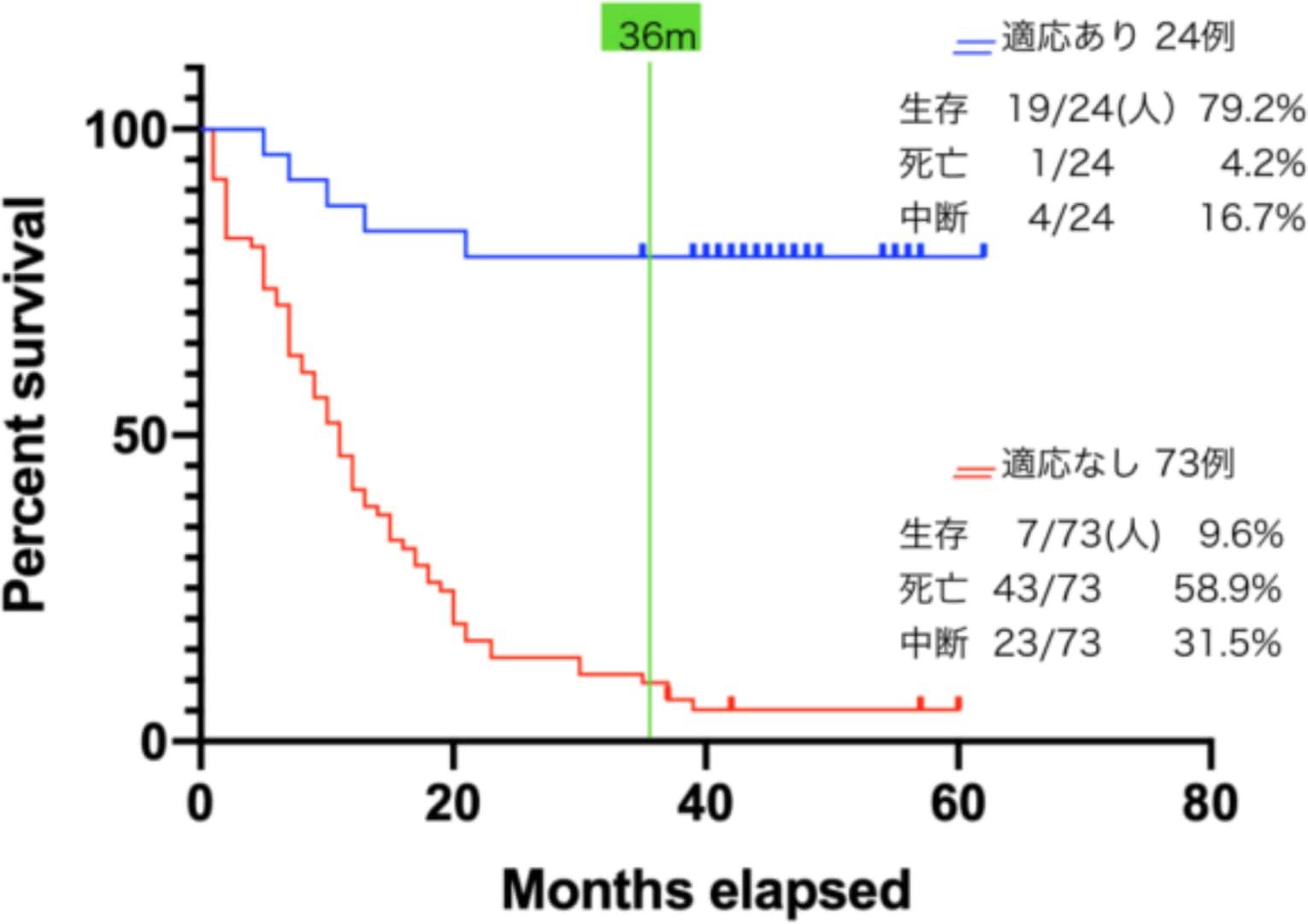
上記の結果をまとめると、第Ⅳ期或いは再発がんに対しての治療計画を立てる上では、腫瘍のワクチン化が大切で、〝免疫療法は、がん治療の最後ではなく、最初に行うべきである〞と言われる所以です。今後、樹状細胞の腫瘍内投与をもっと身近なものにするため、数年前から早稲田大学工学部と共同で穿刺ロボットの開発に向けて取り組んでいます。2005年に頭頸部がん再発で最初の治癒例を経験した時から、有効なプロトコールの作成について悩んできましたが、いまようやくその内容が見えてきたように感じます。
日本国内においては、再生医療法に準じて診療を行なっておりますが、海外ではマレーシアでの臨床試験を始め共同研究の輪を広げています。